Новый механизм потери памяти
"Новый механизм потери памяти, связанный со старением: перспективы для разработки лекарств, которые регулируют эту новую аберрантную сигнализацию"
Понимание процессов отклика нейронов
Исследование, проведенное Луисой Лопес, возглавляющей группу в Институте Молекулярной Медицины Жоао Лобо Антунеса (iMM, Португалия) и опубликованным сегодня в журнале Молекулярная психиатрия, описывает новый механизм потери памяти, связанный со старением.

Исследование, проводимое в течение 3 лет командой португальских, французских и немецких ученых, теперь показывает, что конкретные изменения в сигнале схем, участвующих в памяти, вызывают ненормальный отклик нейронов головного мозга, связанный со старением. Понимание этих процессов имеет решающее значение для определения новых терапевтических стратегий, поскольку старение является самым большим фактором риска развития нейродегенеративных заболеваний.
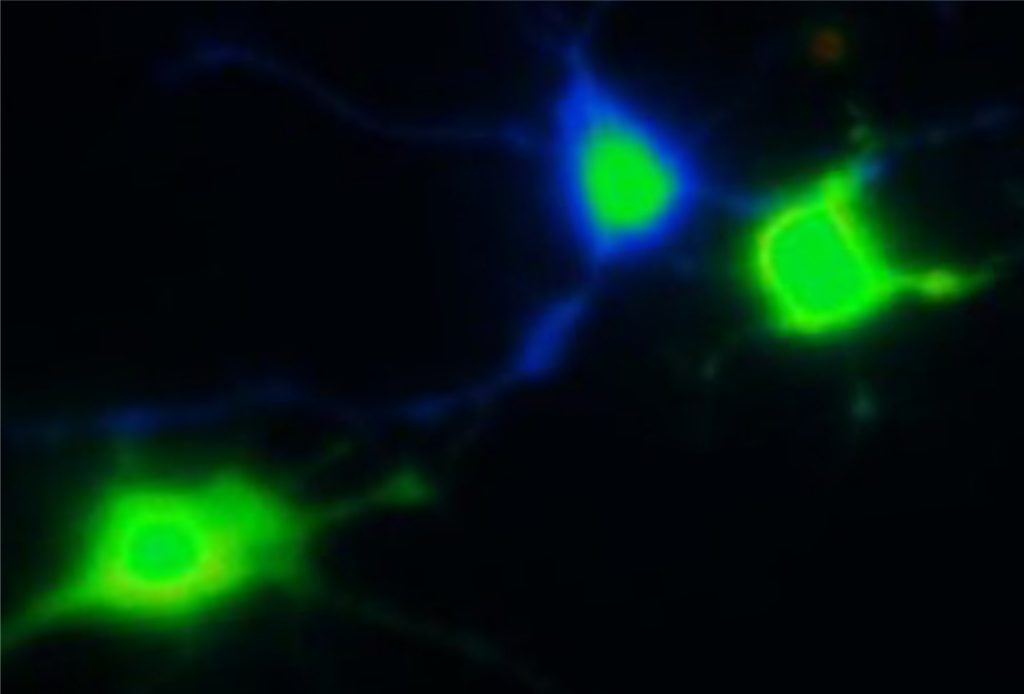
Нейроны гиппокампа, в которых мы можем увеличивать содержание кальция (отмечен зеленым цветом) через NMDA и mGluR5-рецептор при переактивации аденозиновых рецепторов A2A
Ученые изучили мозг пожилых пациентов и впервые обнаружили, что аденозиновый рецептор, называемый A2A (кофеиновая мишень в головном мозге), специально расположен в нейронах. «Мы уже знали, что этот рецептор был увеличен в этих условиях, но мало что известно о типе клеток, в которых фактически были бы установлены рецепторы. Мы продемонстрировали, что эти рецепторы в основном сконцентрированы в нейронах и меньше в глиальных клетках, по крайней мере, у пожилых пациентов», – объясняет Луиза Лопес, исследователь iMM и ведущий ученый.
Чтобы лучше понять эту функцию, команда исследователей сформировала модель для животных, которая воспроизводит увеличение рецептора аденозина в тех же областях мозга, что и у пациентов. Команда обнаружила, что в этих нейронах наблюдается увеличение высвобождения глутамата, самого распространенного нейротрансмиттера в мозге. Используя комбинацию электрических записей и измерений уровня кальция, можно было обнаружить, что в этих условиях происходит переактивация сигнализации глутамата. «Просто изменив количество аденозинового рецептора в нейронах гиппокампа и коры, мы создали профиль, который мы назвали ранним старением, поскольку он вызывает когнитивный дефицит и изменения в передаче нейронов», – объясняет Мариана Темидо, первый автор исследования и студент программы iMM BioMed PhD.
«Чтобы доказать важность этого открытия, мы хотели проверить, действует ли тот же механизм у пожилых животных и не только в нашей модели. С одной стороны, мы продемонстрировали, что сверхактивация глутаматных рецепторов обнаруживается у пожилых животных. С другой стороны, мы показали, что рецептор А2А действительно вовлечен в эту цепь, потому что, когда мы заблокировали его действие, мы нормализовали как функцию нейронов, так и обратную нехватку памяти», – говорит Луиса Лопес.
Эта работа открывает новые перспективы для разработки лекарств, которые регулируют эту новую аберрантную сигнализацию, а именно семейство кофеинов, которое также эффективно тестировалось в исследовании. Кроме того, она позволяет создавать новые модели, которые полезны при понимании старения.